1. 化學平衡的觀察,可由巨視觀點及微視觀點來觀察。當化學反應達平衡時,巨觀性質不再改變,且各種物質的濃度或分壓必須符合平衡常數關係式。但從微視觀點看來,反應處於動平衡狀態,即正向反應速率等於逆向反應速率。
2. 以通式而言,當反應
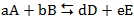
達平衡時,平衡常數
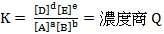
。當反應未平衡時,可由濃度商 Q 與平衡常數 K 的關係,來判斷反應進行的方向:當 Q > K 時,反應往生成物方向進行;當 Q < K 時,反應往反應物方向進行。
3. 判斷平衡常數前,須先觀察反應屬於均勻系或不均勻系。當反應屬於均勻系時,平衡常數可用濃度 (K
C ) 或分壓 (K
P ) 表示,兩者的關係可顯示為:
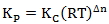
。
若為不均勻系,則須考慮反應物的狀態。一般而言,參與反應物質為氣態時用分壓表示平衡常數;當以濃度表示平衡常數時,則不考慮固態物質。當參與反應物質非水溶液時,尚須考量水的濃度對平衡常數的影響。
4. 當反應方程式改變時,平衡常數 K 的變化如下:
(1) 方程式逆向,則 K 值變倒數。
(2) 方程式係數 n 倍,則 K 值變為 n 次方倍。
(3) 方程式相加,則 K 值相乘。
5. 影響平衡常數與速率常數之因子:
(1) 影響平衡常數之因子:本性(溶劑)、反應熱、溫度。
(2) 影響速率常數之因子:本性(溶劑)、活化能、催化劑、溫度。
6. 勒沙特列原理:在一個平衡物系中,再加入影響之因子(如改變濃度、分壓或溫度),則反應向抵銷此因子之方向進行。催化劑不會影響平衡進行的方向。
(1) 壓力效應:若增加某物分壓,則反應向消耗此物的一方進行。若分壓不變,則反應方向不變。
(2) 溫度效應:溫度增加,反應向吸熱方進行,平衡常數變大;降溫則相反。
7. 難溶性鹽類的離子溶度積為Ksp,會隨本性及溫度改變。
(1) 離子積 > 溶度積,溶液會產生沉澱。
(2) 離子積 = 溶度積,溶液恰飽和。
(3) 離子積 < 溶度積,溶液未飽和。
8. 同離子效應是指當微溶性的電解質溶在含有相同電解質的溶液中,其溶解度較在純水中還小。




