1.
大氣的層次結構:大氣係指地表上可受重力影響的氣體,範圍離地表約1000公里內。空氣係指生物活動範圍內的氣體,約地表上20公里內。
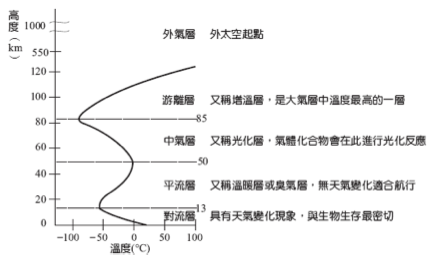
▲ 大氣的分層
2.
大氣循環:大氣中之成分能長久保持不變,主要依賴下列循環不斷進行:
(1) 氮循環:
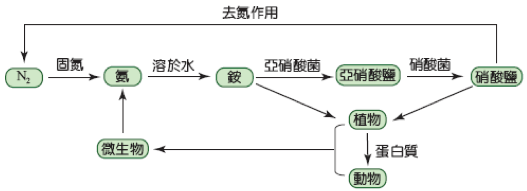
▲ 氮的循環
(2) 二氧化碳與氧循環:
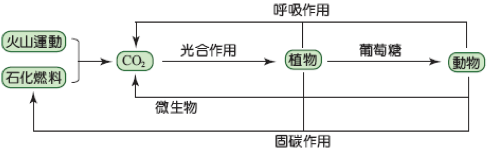
▲ 碳的循環
(3) 水循環:
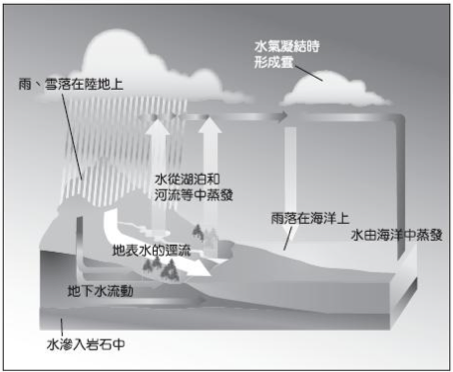
▲ 碳的循環
3. 單位面積上所受的力稱壓力。(P = FA)。
4.
壓力單位:1atm = 76cmHg = 760mmHg = 760torr = 1033.6
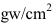
= 1033.6cm 水柱≒ 101300Pa= 1.013b = 1013mb。
5.
理想氣體方程式PV=nRT
| 定律名稱 |
固定值 |
公式 |
| 波以耳定律 |
n、T |
PV = k |
| 查理定律 |
n、P |
V = kT |
| 給呂薩克定律 |
n、V |
P = kT |
| 分壓定律 |
T、V |
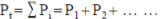 |
| 亞佛加厥定律 |
T、P、V |
n = kV |
(1) 用於氣體或易揮發物質的分子量測定PV =
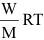
(2) 用於測定S.T.P.下的氣體密度PM = DRT
(3) 計算類型:
- 不起反應時可用消去法或代入法。
- 起反應之題型則依方程式係數及氣體關係求解。
7.
常用單位
(1) 公制單位(MKS) = 國際標準單位(SI制)
(2) 壓力(P):帕(Pa);體積(V):立方公尺(
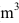
);力(F):牛頓(nt);功(W):焦耳( joule)
(3)
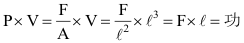
(4) P ×V= nt × m= joule
9.
道耳頓分壓定律:PV=nRT,T、V 一定時,P
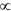
n,(混合氣體若有反應,則必須先算反應,再依剩餘氣體計算)。
12.
格銳目擴散定律:密度分別為 D
1 和 D
2 的兩種氣體,其擴散速率為 R
1 及 R
2。 裝置內於不同狀況下擴散時,將擴散速率直接視為碰撞頻率。
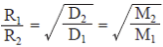
14.
臨界條件
(1) 臨界溫度(T
c):加壓後能使氣體發生液化之最高溫度。
(2) 臨界壓力(PC):臨界溫度下能使氣體液化之最低壓力,或臨界溫度時的飽和蒸氣壓。
(3) 臨界狀況:當純質液氣性質(分子間距離、引力密度)一致,此時就液體而言,分子間距離最大、密度最小;就氣體而言,分子間距離最小、密度最大。
(4) 真實氣體液化條件:T≤TC 且 P > P
飽和
(5) 理想氣體:減溫加壓,永不液化。
(6) 真實氣體:減溫加壓,均可液化。
(7) 水於 25°C 下,飽和蒸氣壓為 24mmHg,臨界溫度 374°C、臨界壓力為218atm:
- A → B → C:T < TC 但 P ≤ P 飽和,無液體。
- C → D:T < TC 且 P > P 飽和,氣體液化(P 不變)。
- D → E:液體壓縮。
