一分鐘準備段考
- 公式的內容、定義、用途要理解,不是死背
- 了解化學反應與常見的反應類型
- 複雜題目的解題流程,要能熟悉
- 利用名師學院系列產品,反覆觀看、補強弱點
|
化學反應
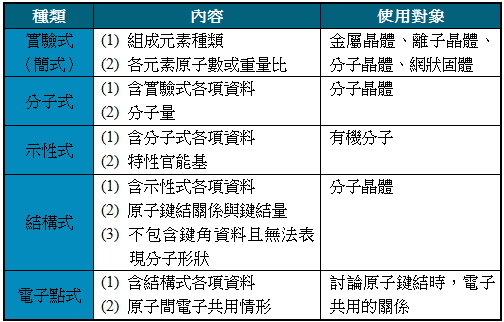
一、化學式種類
1. 實驗式(簡式):表示物質組成元素種類,常用於金屬、分子晶體、離子晶體、網狀固體等無單元分子物質。
2. 分子式:包含實驗式之各項資料,主要用於分子晶體。
3. 示性式:包含分子式之各項資料,可說明具有何種特性之官能基,主要用於同分異構物之有機分子。
4. 結構式:包含示性式之各項資料,可說明原子鍵結關係與鍵結量(結合量),但不包含鍵角資料。
5. 電子點式:包含結構式之各項資料,可說明各原子間電子共用情形。
▼ 化學式種類整理
二、方程式計算
1. 基本步驟:
- 先列出計算所需之方程式並平衡之。
- 方程式係數比及反應時之莫耳數比,均以莫耳數關係再換算成重量或體積。
2. 限量試劑與產量問題︰ - 任何反應中完全被用盡的反應物量可決定生成物的產量,此種完全用盡的試劑稱為限量試劑。
- 依照限量試劑求出之產量稱為理論產量,依照實驗測得之產量為實際產量。
 - 凡已知條件中有多項反應物之用量,則必須考慮限量試劑。
3. 熱含量(焓、Enthalpy、H)為物質生成時,儲存於其中之能量總和,物質之絕對熱含量大小無法求出,只能比較其相對大小。
4. 反應熱 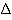 H (T、P) 為反應前後生成物系與反應物系之總熱含量變化,與反應物路徑或反應速率快慢無關。
▼ 熱含量與反應熱之比較 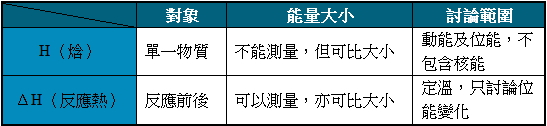
5. 生成熱為一純質由其最安定或標準晶型成分元素態形成化合物時的能量變化,最安定或標準晶型元素態其生成熱定為零。分解熱和生成熱同值異號。
6. 燃燒熱為一可燃物與氧完全燃燒所放出的能量,恆為放熱。最高氧化數的氧化物和不能燃燒的元素其燃燒熱定為零。
7. 卡計可用來測定反應熱,使整個卡計升高 1ºC 所需的熱量,為該卡計之水當量。
8. 赫斯(赫士)定律亦為反應熱加成定律
- 若一反應能以兩個或以上其他反應的代數和表示,其反應熱為所有反應熱的代數和。
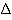 H = 生成物總生成熱 = 反應物總生成熱 = 反應物總燃燒熱 = 生成物總燃燒熱 H = 生成物總生成熱 = 反應物總生成熱 = 反應物總燃燒熱 = 生成物總燃燒熱
常見的化學反應類型
一、化學反應類型分成
1. 依反應前後物質的種類或數目的變化區分成結合(化合)反應、分解反應、取代(置換)反應、複分解(複取代)反應及燃燒反應。
▼依反應前後物質的種類或數目的變化區分 
2. 依化學反應特性區分成沉澱反應、酸鹼反應及氧化還原反應。
- 沉澱反應:不同電解質溶於水後,陰陽離子交互作用,結合產生難溶性物質。
- 酸鹼反應:酸鹼反應成鹽類及水。
- 氧化還原反應:電子得失造成氧化劑得電子,還原劑失電子。
二、溶解度與沉澱反應
1. 溶液中析出固體的過程稱為沉澱。
2. 當兩溶液混合時,若反應生成新物質,而此物質難溶於水時,即產生沉澱,故可利用此特性進行分離。
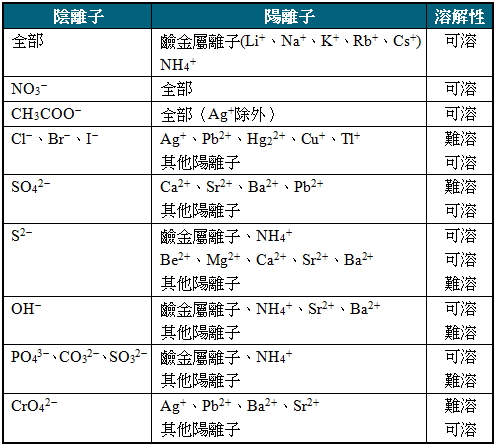
3. 將電解質分解為陰陽離子,以沉澱表作為是否沉澱的判斷依據。
▼沉澱表
三、電解質與非電解質:
1. 定義:
- 電解質:化合物水溶液或熔融態可導電者。
- 非電解質:於水中不可導電或不屬於電解質者。
2. 電解質分類︰
- 分子化合物(酸、氨):熔融態不導電,水溶液導電,如:
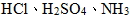 。 。
- 離子化合物(鹼、鹽):熔融態及水溶液皆可導電,如:
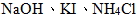 。 。
四、酸鹼反應
1. 定義:
- 酸:具有酸味,能使藍色石蕊試紙變紅色,可與鋅等活潑金屬反應產生氫,可導電。在水溶液中生成氫離子,可與鹼溶液反應生成鹽類和水。
- 鹼:水溶液具有澀味及滑膩感,能使紅色石蕊試紙變藍色,可導電。於水中生成氫氧根離子,能與酸溶液反應生成鹽類和水。
2. 酸鹼中和為酸與鹼反應形成鹽與水的過程,在反應的過程中,可透過指示劑的變色協助判斷反應是否達到反應終點。指示劑多半為弱酸或弱鹼,添加在溶液中時,可依氫離子濃度的不同而呈現不同的顏色。
3. 酸鹼中和反應為放熱反應,強酸強鹼反應放熱大於弱酸弱鹼。
4. 強酸與強鹼反應,其淨離子方程式皆為 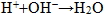 。 5. 水視為極弱的電解質,可解離出 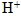 與 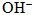 。水溶液中, 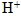 與 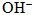 的體積莫耳濃度乘積為水的離子積常數(Kw),即[ 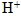 ][ 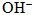 ] = Kw,pH + pOH = pKw。 6. 水的離子積與溫度有關,溫度愈高Kw愈大。
7. 水的解離過程為吸熱反應,溫度愈高,愈利於水的解離。
8. pH值為 [ 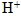 ] 對數值的負值 pH= -log[ 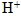 ] 或 [ 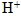 ] = 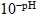 ,同理
pOH = -log [ 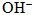 ] 或 [ 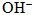 ] = 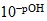 。 五、氧化還原反應
1. 氧化還原之定義: - 氧化:與氧結合,失去電子,氧化數增加。
- 把氧脫除,獲得電子,氧化數減少。
2. 氧化半反應所失去的電子總數必與還原半反應所得到的電子總數相等。
3. 氧化與還原兩者必相伴發生,不會只單一發生氧化或還原。

|




