一分鐘準備段考
- 公式的內容、定義、用途要理解,不是死背
- 各原子假說與特性要熟記
- 複雜題目的解題流程,要能熟悉
- 利用名師學院系列產品,反覆觀看、補強弱點
|
原子結構與週期表
一、基本粒子的發現過程
▼提出者與發現過程
| 提出者 |
內容 |
| 道耳頓 |
原子說——原子不可分割 |
| 法拉第 |
電解定律——原子可形成離子 |
| 湯姆森 |
陰極射線實驗——確認電子及獲得電子的荷質比 |
| 密立坎 |
油滴實驗——測出電子電量及推出電子質量 |
| 拉塞福 |
α粒子撞擊氮原子核——發現質子 |
| 阿斯通 |
質譜儀——發現同位素及推定中性粒子的存在 |
| 查兌克 |
α粒子撞擊鈹原子核——發現中子 |
二、原子模型的演變過程
▼提出者與相關內容及原子模型錯誤之處
| 提出者 |
原子模型之內容 |
錯誤之處 |
| 道耳頓 |
原子說——原子不可分割 |
發現原子內有更小粒子 |
| 湯姆森 |
葡萄乾麵包模型(西瓜模型)——原子內含有電子及正電,質量為均勻分布 |
發現原子內質量非均勻分布 |
| 拉塞福 |
行星模型——原子中質量集中在帶正電的原子核內,帶負電之電子以圓周運動繞行 |
電子會依正、負電荷相吸而墜入原子核內,此無法解釋古典電磁輻射理論 |
| 波耳 |
早期量子化模型——電子能量不連續,而以能階存在,電子只能停留在特定的能階。電子在基態時不再輻射能量 |
無法解釋多電子系之光譜數據 |
三、原子的特性
1. 最外層之電子,可參與化學反應,因此原子的最外殼層稱為價軌域。價軌域所含電子數目即為價電子,價電子可決定該元素之化學性質。
2. 金屬性︰
- 同族愈往下,金屬性愈強
- 同週期愈往右,金屬性漸弱
- 可由元素名稱判定
3. 原子半徑︰
- 同族愈往下,半徑愈大
- 同週期愈往右,半徑愈小
- 各週期以 Ⅰ A 最大
- 右上角(除鈍氣)之 N 、 O 、 F 均為甚小原子
4. 離子半徑︰
- 同一元素,陽離子 < 中性原子 < 陰離子
- 等電子組態,原子序愈大,半徑愈小
化學反應熱
一、化學式種類
1. 實驗式(簡式):表示物質組成元素種類,常用於金屬、分子晶體、離子晶體、網狀固體等無單元分子物質。
2. 分子式︰包含實驗式之各項資料,主要用於分子晶體。
3. 示性式︰包含分子式之各項資料,可說明具有何種特性之官能基,主要用於同分異構物之有機分子。
4. 結構式︰包含示性式之各項資料,可說明原子鍵結關係與鍵結量(結合量),但不包含鍵角資料。
5. 電子點式︰包含結構式之各項資料,可說明各原子間電子共用情形。
▼化學式種類整理
| 種類 |
內容 |
使用對象 |
實驗式
(簡式) |
1. 組成元素種類
2. 各元素原子數或重量比 |
金屬晶體、離子晶體、分子晶體、網狀固體 |
| 分子式 |
1. 含實驗式各項資料
2. 分子量 |
分子晶體 |
| 示性式 |
1. 含分子式各項資料
2. 特性官能基 |
有機分子 |
| 結構式 |
1. 含示性式各項資料
2. 原子鍵結關係與鍵結量
3. 不包含鍵角資料且無法表現分子形狀 |
分子晶體 |
| 電子點式 |
1. 含結構式各項資料
2. 原子間電子共用情形 |
討論原子鍵結時,電子共用的關係 |
二、方程式計算
1. 基本步驟︰
- 先列出計算所需之方程式並平衡之
- 方程式係數比及反應時之莫耳數比,均以莫耳數關係再換算成重量或體積。
2. 限量試劑與產量問題︰
- 任何反應中完全被用盡的反應物量可決定生成物的產量,此種完全用盡的試劑稱為限量試劑
- 依照限量試劑求出之產量稱為理論產量,依照實驗測得之產量為實際產量
- 產率 =
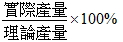
- 凡已知條件中有多項反應物之用量,則必須考慮限量試劑
三、各種反應熱的說明
1. 熱含量(焓、Enthalpy、H)為物質生成時,儲存於其中之能量總和,物質之絕對熱含量大小無法求出,只能比較其相對大小。
2. 反應熱ΔH(T、P)為反應前後生成物系與反應物系之總熱含量變化,與反應物路徑或反應速率快慢無關。
|
對象 |
能量大小 |
討論範圍 |
| H(焓) |
單一物質 |
不能測量,但可比大小 |
動能及位能,不包含核能 |
ΔH
(反應熱) |
反應前後 |
可以測量,亦可比大小 |
定溫,只討論位能變化 |
3. 生成熱為一純質由其最安定或標準晶型成分元素態形成化合物時的能量變化,最安定或標準晶型元素態其生成熱定為零。分解熱和生成熱同值異號。
4. 燃燒熱為一可燃物與氧完全燃燒所放出的能量,恆為放熱。最高氧化數的氧化物和不能燃燒的元素其燃燒熱定為零。
5. 卡計可用來測定反應熱,使整個卡計升高 1ºC 所需的熱量,為該卡計之水當量。
6. 赫斯(赫士)定律亦為反應熱加成定律︰
- 若一反應能以兩個或以上其他反應的代數和表示,其反應熱為所有反應熱的代數和
- ΔH = 生成物總生成熱 = 反應物總生成熱 = 反應物總燃燒熱 = 生成物總燃燒熱

|