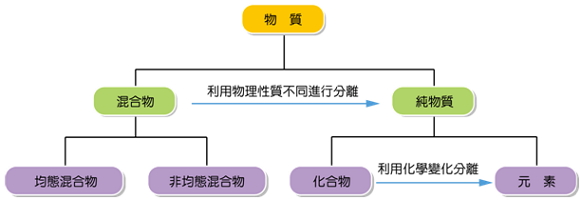
2.純物質和混合物之間的差異在於:純物質具有一定的物理性質,混合物則否,可利用物性常數來加以區別。
3. 元素和化合物之間的差異在於:元素只含一種原子,化合物則可經由化學方法處理成不同物種,可利用化學性質來加以區別。
4. 物質的物理性質及化學性質各有不同,可利用此性質透過物理方法(過濾、蒸發、萃取)或利用化學方法(沉澱反應、酸鹼中和…等),加以分離及純化物質。
▼物理方法與化學方法的差異
| 物理方法 | 化學方法 | |
| 定義 | (1) 利用物理性質的差異,來分離物質 (2) 僅外觀、大小及形狀發生改變 (3) 分離的前後其本性不變 |
(1) 利用化學性質的差異,來分離物質 (2) 物質內部會因斷鍵、生成鍵發生原子重新排列組合,但反應前、後原子不滅 (3) 經由得失電子使本性發生改變 |
| 能量差異 | 因物理方法產生的物理變化最高能量不超過100kJ/mol | 因化學方法產生的化學變化最高不超過1000kJ/mol |
| 例子 | 過濾、蒸餾、層析 | 電解、沉澱 |
5. 道耳頓依據質量守恆定律、定比定律及倍比定律推出原子說。
▼質量守恆定律、定比定律及倍比定律之介紹
| 定律 | 提出人 | 內容 |
| 質量守恆定律 | 拉瓦錫(節) | 反應前、後,質量總和必相等 |
| 定比定律 | 普魯(勞)斯特 | (1) 針對1種化合物探討 (2) 指來源不同、組成相同 |
| 倍比定律 | 道耳頓(吞) | (1) 針對2種化合物探討 (2) 固定其一,另一成簡單整數比 |
6. 氣體反應體積定律:氣體物質相互反應或生成物有氣體時,反應物或生成物中的氣體體積,在同溫、同壓時,恆成簡單整數比。
7. 亞佛加厥假說:同溫、同壓下,同體積的任何氣體含有相同數目的分子數(莫耳數),其體積正比莫耳數。
8. 莫耳運算時常見之關係:
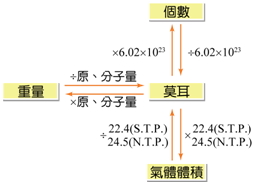
▲莫耳與個數、重量、氣體體積之關係
溶液
1. 溶液可依存在相、溶劑的種類或導電性作分類。
2. 廷得耳效應:光線通過膠體溶液,則顯現出一條光亮的通路。
3. 布朗運動:光線通過膠體溶液時,膠質粒子成無數光點,且不停作急速運動。
4. 膠質粒子帶有電荷,若加入電解質溶液則會有鹽析現象產生。
5. 溶液計算之重要公式:

6. 依溶質溶解的程度其溶液可分為未飽和、飽和及過飽和。
7. 溶解度指定溫下溶劑每100公克所能溶解溶質之最大克數。
8. 結晶水與非結晶水的計算方式:
(1) 不含結晶水需利用溶質、溶劑、溶液、加入量、析出量之對應關係,由比例關係求計。
(2) 含結晶水需先找出無水物之溶質、溶劑重,才可計算溶解度。
9. 由溶解度曲線判斷溶液情形:
(1) A點在曲線上方為過飽和,可透過加熱、加溶劑、析出溶質使其變飽和。
(2) B點在曲線下方為未飽和,可透過降溫、加溶質、蒸發溶劑使其變飽和。
(3) C點於曲線上為恰飽和。
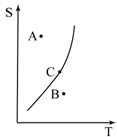
▲溶解度與溫度之關係
10. 氣體之溶解度與其分壓成正比時,可透過亨利定律求計(適用稀薄溶液)。
11. 氣體分子於液面的碰撞頻率與分子個數成正比,因此溶解度與氣體在液面之分壓呈線性關係。
12. 溶解度會受到溶質與溶劑的本性、溫度及壓力而改變。
(1) 分子間作用力相似時較容易互溶。
(2) 溶解熱為吸熱時,其溶解度會隨溫度而增加;反之,溶解熱為放熱,溶解度則會變小。
(3) 對氣體而言,當溫度升高,受到氣體分子的平均動能的影響,氣體溶質較易掙脫溶劑的束縛,因此造成溶解度減小。
(4) 壓力對固體及液體之溶解度影響較小,但對氣體而言,仍需依亨利定律(m=kP)。
2. 廷得耳效應:光線通過膠體溶液,則顯現出一條光亮的通路。
3. 布朗運動:光線通過膠體溶液時,膠質粒子成無數光點,且不停作急速運動。
4. 膠質粒子帶有電荷,若加入電解質溶液則會有鹽析現象產生。
5. 溶液計算之重要公式:

6. 依溶質溶解的程度其溶液可分為未飽和、飽和及過飽和。
7. 溶解度指定溫下溶劑每100公克所能溶解溶質之最大克數。
8. 結晶水與非結晶水的計算方式:
(1) 不含結晶水需利用溶質、溶劑、溶液、加入量、析出量之對應關係,由比例關係求計。
(2) 含結晶水需先找出無水物之溶質、溶劑重,才可計算溶解度。
9. 由溶解度曲線判斷溶液情形:
(1) A點在曲線上方為過飽和,可透過加熱、加溶劑、析出溶質使其變飽和。
(2) B點在曲線下方為未飽和,可透過降溫、加溶質、蒸發溶劑使其變飽和。
(3) C點於曲線上為恰飽和。

▲溶解度與溫度之關係
10. 氣體之溶解度與其分壓成正比時,可透過亨利定律求計(適用稀薄溶液)。
11. 氣體分子於液面的碰撞頻率與分子個數成正比,因此溶解度與氣體在液面之分壓呈線性關係。
12. 溶解度會受到溶質與溶劑的本性、溫度及壓力而改變。
(1) 分子間作用力相似時較容易互溶。
(2) 溶解熱為吸熱時,其溶解度會隨溫度而增加;反之,溶解熱為放熱,溶解度則會變小。
(3) 對氣體而言,當溫度升高,受到氣體分子的平均動能的影響,氣體溶質較易掙脫溶劑的束縛,因此造成溶解度減小。
(4) 壓力對固體及液體之溶解度影響較小,但對氣體而言,仍需依亨利定律(m=kP)。
原子結構與週期表
1. 基本粒子的發現過程
2. 原子模型的演變過程
3. 最外層之電子,可參與化學反應,因此原子的最外殼層稱為價軌域。價軌域所含電子數目即為價電子,價電子可決定該元素之化學性質。
4. 金屬性:
(1) 同族愈往下,金屬性愈強。
(2) 同週期愈往右,金屬性漸弱。
(3) 可由元素名稱判定。
5. 原子半徑:
(1) 同族愈往下,半徑愈大。
(2) 同週期愈往右,半徑愈小。
(3) 各週期以ⅠA最大。
(4) 右上角(除鈍氣)之N、O、F均為甚小原子。
6. 離子半徑:
(1) 同一元素,陽離子 < 中性原子 < 陰離子。
(2) 等電子組態,原子序愈大,半徑愈小。
▼提出者與發現過程
| 提出者 | 內容 |
| 道耳頓 | 原子說——原子不可分割 |
| 法拉第 | 電解定律——原子可形成離子 |
| 湯姆森 | 陰極射線實驗——確認電子及獲得電子的荷質比 |
| 密立坎 | 油滴實驗——測出電子電量及推出電子質量 |
| 拉塞福 | α粒子撞擊氮原子核——發現質子 |
| 阿斯通 | 質譜儀——發現同位素及推定中性粒子的存在 |
| 查兌克 | α粒子撞擊鈹原子核——發現中子 |
▼提出者與相關內容及原子模型錯誤之處
| 提出者 | 原子模型之內容 | 錯誤之處 |
| 道耳頓 | 原子說——原子不可分割 | 發現原子內有更小粒子 |
| 湯姆森 | 葡萄乾麵包模型(西瓜模型)——原子內含有電子及正電,質量為均勻分布 | 發現原子內質量非均勻分布 |
| 拉塞福 | 行星模型——原子中質量集中在帶正電的原子核內,帶負電之電子以圓周運動繞行 | 無法解釋古典電磁輻射理論,即電子將墜入原子核內 |
| 波耳 | 早期量子化模型——電子能量不連續,而以能階存在,電子只能停留在特定的能階。電子在基態時不再輻射能量 | 無法解釋多電子系之光譜數據 |
3. 最外層之電子,可參與化學反應,因此原子的最外殼層稱為價軌域。價軌域所含電子數目即為價電子,價電子可決定該元素之化學性質。
4. 金屬性:
(1) 同族愈往下,金屬性愈強。
(2) 同週期愈往右,金屬性漸弱。
(3) 可由元素名稱判定。
5. 原子半徑:
(1) 同族愈往下,半徑愈大。
(2) 同週期愈往右,半徑愈小。
(3) 各週期以ⅠA最大。
(4) 右上角(除鈍氣)之N、O、F均為甚小原子。
6. 離子半徑:
(1) 同一元素,陽離子 < 中性原子 < 陰離子。
(2) 等電子組態,原子序愈大,半徑愈小。





