一分鐘準備段考
- 熟記各類定義、定理
- 自己整理重點,幫助理解,深化記憶
- 多做題目,了解題型方向,訓練解題技巧
- 利用名師學院系列產品,反覆觀看、補強弱點
|
酸鹼鹽
1. 凡溶於水(或在熔融狀態下)會分解成帶正、負電的離子且能導電的化合物,此稱為電解質,反之不溶於水或溶於水但不導電者為非電解質。
2. 電解質溶解在水中,分解成帶正電的正離子(陽離子)和帶負電的負離子(陰離子),當通以電流時,離子就會因為正、負相吸的原理而移動,且必會產生化學變化。凡溶於水而不能導電的化合物即為非電解質。
(1) 常見的正離子: 氫離子( 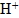 )、鈉離子( 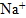 )、鈣離子( 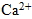 )、銨根離子( 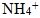 )。
(2) 常見的負離子:氫氧根離子( 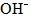 )、氯離子( 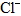 )、硫酸根離子( 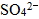 )、硝酸根離子( 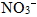 )。
(3) 數個原子形成的粒子叫原子團,若帶電則稱為根。
3. 電解質可概分為三大類:
(1) 酸類:在水中可解離出氫離子的化合物,其水溶液常稱為「某酸」。
① 醋酸 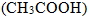 :部分解離
② 鹽酸 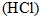 :100%解離
③ 硫酸 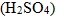 :100%解離
④ 硝酸 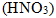 :100%解離
(2) 鹼類:在水中可解離出氫氧根離子的化合物。
① 氫氧化鈣 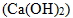 :100%解離
② 氫氧化鈉 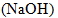 :100%解離
③ 氨 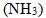 :部分解離
(3) 鹽類:酸鹼中和或酸與某些金屬作用的產物。
① 氯化鈉 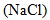 :

② 硝酸鉀 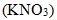 :

4. 解離說:解離時,溶液中正離子所帶的總電量與負離子所帶的總電量必相等,使溶液保持電中性,但正離子與負離子的個數卻不一定相等。
5. 電解質的導電原理:當溶液通以電流(直流電)時,溶液中的正離子移向負極,負離子移向正極,形成電流,使水溶液可以導電。
6. 常見的酸鹼指示劑,如下表:
| 指示劑 |
酸性溶液中顏色 |
pH變色範圍 |
鹼性溶液中顏色 |
| 石蕊 |
紅 |
5.4~8.0 |
藍 |
| 酚紅 |
黃 |
6.4~8.2 |
紅(粉紅) |
| 酚酞 |
無 |
8.3~10.0 |
紅(粉紅) |
| 廣用 |
紅、橙、黃 |
中性為綠色 |
藍、靛、紫 |
| 甲基橙 |
紅 |
3.1~4.4 |
黃 |
| 甲基紅 |
紅 |
4.2~6.3 |
黃 |
| 溴瑞香草藍 |
紅、黃 |
1.2~6.2~7.6 |
藍 |
7. 酸的通性:
(1) 若酸類不加水則無法解離出氫離子,所以濃酸(硫酸、冰醋酸)本身不會導電,且呈中性非酸性。
(2) 而將酸性溶液稀釋之後,強酸(如:鹽酸、硫酸、硝酸等)的氫離子可100%解離,導電性強,為強電解質;弱酸(如:醋酸)的氫離子僅部分解離,較不易導電,為弱電解質。
(3) 水溶液中可解離出氫離子者,稱為阿瑞尼斯酸。
(4) 濃酸加水稀釋則會放熱,使水溫上升,因此稀釋時須將酸緩緩沿玻璃棒倒入水中,而非水倒入酸中。
(5) 大多數的酸性水溶液與鐵、鎂、鋅等活性大於氫的金屬反應,可產生氫氣 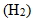 ,以點燃的火柴靠近收集氣體的試管口會產生爆鳴聲。
(6) 酸性水溶液與碳酸鈣 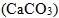 反應,可產生二氧化碳 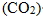 氣體。
8. 鹼的通性:
(1) 鹼性物質溶於水可解離出氫氧根離子 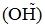 ,可導電,屬於電解質。
(2) 水溶液中可解離出氫氧根離子者,稱為阿瑞尼斯鹼。
(3) 鹼性物質因在水中解離的程度不同,故電解質有強弱之分。
① 強鹼(如:氫氧化鈉)在水中可100%解離出氫氧根離子,導電性強,為強 電解質。
② 弱鹼(如:氨)的氫氧根離子在水中僅部分解離,較不易導電,為弱電解 質。
9. 一定量之溶液中,所含溶質的量,亦為溶液的濃稀程度,稱為濃度。
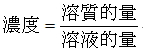
10. 常見的濃度表示法:
11. pH值定義:當溶液中的 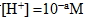 時,則令溶液的pH值為a
(1) pH 值愈小,表示氫離子莫耳濃度愈大,溶液的酸性愈強。
(2) 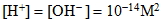 (兩者成反比)。
(3) 在25°C、1atm 下每1 公升的純水,可解離出 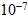 莫耳的氫離子( 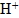 ) 與 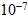 莫耳的氫氧根離子( 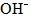 )。在此狀態下,純水中的[ 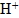 ]=[ 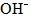 ]= 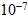 (M)。
12. 酸鹼中和通式:酸 + 鹼→ 鹽 + 水 + 熱。(離子方程式: 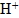 + 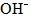 → 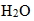 )
(1) 酸鹼中和後溶液的酸鹼度須由酸在水中解離的氫離子( 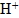 ) 數目與鹼在水中解離的氫氧根離子( 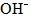 ) 數目來決定。
(2) 酸鹼中和時,水溶液的溫度會上升,可知此反應是一種放熱反應。
(3) 強酸 + 強鹼→ 中性鹽 + 水。
(4) 強酸 + 弱鹼→ 酸性鹽(弱酸性) + 水。
(5) 弱酸 + 強鹼→ 鹼性鹽(弱鹼性) + 水。
13. 酸鹼滴定:利用酸鹼中和反應測定未知溶液的濃度。將已知濃度的氫氧化鈉溶液,滴入未知濃度的鹽酸之中,產生酸鹼中和反應,並且求出待測鹽酸的濃度,完全滴定(滴定終了)其 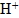 莫耳數會與 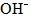 莫耳數相等。
14. 常見的鹽類
(1) 氯化鈉 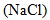 :工業上的重要原料,但若電解熔融態的食鹽則會得到金屬鈉及氯氣。
(2) 硫酸鈣 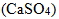 :白色固體,難溶於水(易沉澱),為石膏 ( 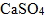 .2 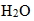 ) 的主要成分。一般常見的燒石膏( 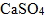 ‧ 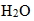 ‧ 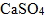 ) 為2 個硫酸鈣共享1 個結晶水的結構,遇水即硬化。
(3) 碳酸鈣 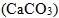 :白色固體,極難溶於水,俗稱灰石。為自然界中大理石、石灰岩、珊瑚、貝殼、珍珠等的主要成分。工業上亦可用來作建築材料。
(4) 碳酸鈉 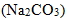 :白色固體,易溶於水,水溶液呈鹼性。俗稱蘇打,又名純鹼,簡稱鹼。碳酸鈉也常被拿來當作清潔劑的一種成分,故又稱洗滌鹼。
(5) 碳酸氫鈉 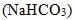 :白色固體,易溶於水,水溶液呈弱鹼性。俗稱小蘇打。胃藥制酸劑中的一種成分,可中和胃酸(胃酸的pH 值為1.5)。碳酸氫鈉遇酸會產生二氧化碳氣體,某些市售的發粉、焙粉便含有碳酸氫鈉及一種弱酸(如:酒石酸氫鉀),所以碳酸氫鈉又稱焙用鹼。碳酸氫鈉亦為滅火器的主要成分:
① 酸鹼滅火器:利用碳酸氫鈉(多)與酸(濃硫酸,少)起中和反應會產生二氧化碳氣體的原理。
反應方程式: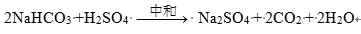
② 乾粉滅火器:利用碳酸氫鈉粉末受熱產生二氧化碳的原理。鋼筒裡面盛有小蘇打乾粉和高壓氮氣  ,故較便宜,且性質安定不活潑。
反應方程式: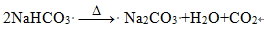
(6) 碳酸鈉與碳酸氫鈉比較:
| 學名 |
俗名 |
物態
顏色 |
對水
溶解度 |
水溶液酸鹼性 |
與酸
反應 |
加熱
反應 |
碳酸鈉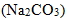 |
蘇打、
洗滌鹼 |
固體
白色 |
易溶
(較大) |
鹼
(稍強) |
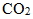 |
沒反應 |
碳酸氫鈉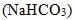 |
小蘇打、焙用鹼 |
固體
白色 |
易溶
(較小) |
鹼
(稍弱) |
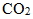 |
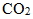 |
氧化與還原
1. 物質與其他物質發生化學反應的難易程度稱為物質的活性
(1) 金屬的活性,視其失去電子的傾向而定;非金屬的活性,視其得到電子的傾向而定。
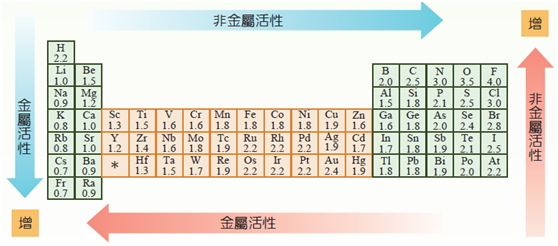
2. 而較常見金屬元素的活性大小如下所示,一般活性大的元素易以化合物的形態存在。鉀(K)>鈉(Na)>鈣(Ca)>鎂(Mg)>鋁(Al)>碳(C)>鋅(Zn)>鉻(Cr)>鐵(Fe) >鈷(Co)>鎳(Ni)>錫(Sn)>鉛(Pb) >氫(H)>銅(Cu)>汞(Hg)>銀(Ag)>鉑(Pt) >(Au)。
(1) 活性大的元素愈不安定,比較容易與氧起作用,且反應較為劇烈,但反應後形成的氧化物比較穩定。例如:鎂(Mg) 易與氧反應形成穩定的氧化鎂(MgO)。
(2) 活性小的元素本身較為安定,不易與氧作用,甚至完全不起反應,但是反應後所生成的氧化物相對地較不穩定。例如:氧化銅(CuO) 易失去氧,形成較安定的銅(Cu)。
(3) 活性大的金屬在反應中可取代(置換)化合物中活性較小的元素。
(4) 有些金屬雖然活性大、容易氧化,但因為氧化反應在表面生成一層薄薄的、質地緻密的氧化物,反而可保護裡面的金屬不再繼續氧化。
3. 氧化物的性質
(1) 金屬、非金屬於空氣中燃燒,會與氧形成氧化物,而氧化物的性質會依來源不同,其酸鹼性不同。
(2) 金屬氧化物溶於水後,其水溶液呈鹼性,可使石蕊試紙呈藍色,使廣用試紙呈藍、靛、紫色。
(3) 非金屬氧化物溶於水後,水溶液呈酸性,使石蕊試紙呈紅色,使廣用試紙呈紅、橙、黃色。
(4) 將鎂、鋅、銅粉分別置於燃燒匙中,以酒精燈加熱使其燃燒,觀察結果如下:
觀察項目
/元素 |
外觀 |
燃燒情形 |
火焰顏色 |
燃燒產物 |
產物
溶水性 |
產物於水中酸鹼性 |
鎂(Mg) |
銀白色
(灰) |
劇烈起火燃燒 |
白色強光 |
氧化鎂(MgO)
白色 |
略溶 |
廣用試紙呈藍紫色,鹼性較強 |
鋅(Zn) |
銀白色
(灰) |
緩慢燃燒 |
黃綠色 |
氧化鋅
(ZnO)
灰白色 |
難溶 |
廣用試紙呈藍色,鹼性較弱 |
銅(Cu) |
紅棕色
(暗紅) |
極高溫時短暫燃燒 |
綠色 |
氧化銅
(CuO)
黑色 |
極難 |
廣用試紙呈綠色,中性 |
(5) 依照燃燒實驗反應的劇烈程度判斷鎂、鋅、銅三種金屬元素對氧反應的活性大小為:鎂(Mg) >鋅(Zn) >銅(Cu)
(6) 將硫粉、紅磷、碳粉分別置於燃燒匙中,以酒精燈加熱使其燃燒,觀察結果如下表:
觀察項目
/元素 |
外觀 |
燃燒情形 |
火焰顏色 |
燃燒產物 |
產物
溶水性 |
產物於水中酸鹼性 |
硫粉(S) |
黃色 |
刺激性臭味的氣體 |
藍紫色 |
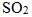
(氣體) |
易溶 |
廣用試紙呈紅色 |
紅磷(P) |
暗紅 |
白煙(固體) |
黃白色 |
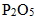
(固體) |
略溶 |
廣用試紙呈黃色 |
碳粉(C) |
黑 |
無色、無味的氣體 |
黃紅色 |
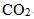
(氣體)
|
略溶 |
廣用試紙呈黃色 |
4. 高爐煉鐵
(1) 原料:鐵礦、焦炭(煤焦)、灰石 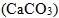 。
① 工業上利用高爐煉鐵,以焦炭做為還原劑。
② 鐵礦必須是氧化鐵,一般使用赤鐵礦 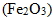 ,若是使用褐鐵礦( 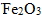 •3 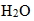 )或菱鐵礦 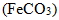 ,則需要先加熱鍛燒去除水分或分解成氧化鐵後才可進行冶煉。黃鐵礦 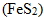 則因為硫不易去除,不適合煉鐵。
(2) 步驟:
① 將鐵礦與灰石 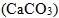 在燒結工廠先引火燃燒,形成半熔融狀態的燒結塊,使適於高爐冶煉,再與焦炭依適當比例送入高爐。
② 焦炭在氧氣不足的情況下燃燒不完全,生成一氧化碳及大量的熱。 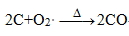
③ 灰石 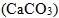 在高爐中,受熱分解為氧化鈣(CaO) 與二氧化碳。
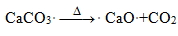
二氧化碳再與焦炭反應生成一氧化碳。
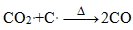
④ 由②③所產生的一氧化碳可將氧化鐵還原為熔化的鐵。
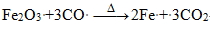
⑤ 焦炭也可將氧化鐵直接還原為熔化的鐵。
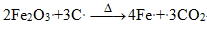
⑥ 氧化鈣(CaO) 則與礦石中的泥沙 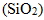 作用生成熔渣。熔渣熔點較低,密度較小,浮在液態鐵的表面,可防止鐵再被氧化。熔渣由出渣口流出,而熔化的鐵則由底部出鐵口導出。
⑦ 高爐所提煉出的鐵為生鐵,含碳量及雜質較多。
5. 生活中常見的氧化劑
(1) 氯氣 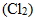 :
① 氯常用來消毒自來水,也是藉氧化作用,除去自來水中的有害微生物。
② 氯也能與金屬鈉進行氧化還原反應產生食鹽。
(2) 次氯酸鈉 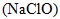 水溶液(俗稱漂白液):
① 次氯酸鈉為強氧化劑,也是常見的漂白劑,用於紙漿、木製品和棉麻纖維的漂白處理。
② 次氯酸鈉加水稀釋後,還可用於環境和物品的消毒,達到殺菌的目的。
(3) 臭氧 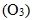 :
① 臭氧的化學活性非常活潑,具有極強的氧化力,可達到殺菌、除臭、解毒、漂白、保鮮等功效(美國的旅館和監獄即是利用臭氧來處理髒衣物)。
② 學術單位實驗報告指出,水中臭氧濃度在0.05ppm 時,只需經1~2 分鐘處理,細菌的致死率就可達到99%以上。
(4) 綠色植物行光合作用時,將太陽能轉化成化學能儲存於我們的食物中,同時產生氧氣,是自然界中最重要的還原反應,反應式為:

6. 工業上常見之氧化還原反應
(1) 金屬的冶煉(冶金):
① 利用氧化還原的方法,將礦物中的金屬提煉出來。
② 轉換(取代)反應:利用活性較大的物質,將活性較小的物質從化合物中轉換出來。A+BC → B +AC,則活性:A> B。
③ 因為碳在高溫時活性較大且價格便宜,常被利用來將礦物中的鋅、鐵、鉛、銅等金屬自氧化物中還原出來。
(2) 電解、電鍍:本身不能產生自發性的氧化還原反應,但經由外部提供能量,例如:電池提供能量給電解槽,則可產生電解反應或電鍍。

| 



